Άλλοι ερευνητές διαπίστωσαν ότι «το μικροβίωμα του εντέρου μπορεί να αποτελέσει προδιάθεση για υγιή άτομα στον COVID-19» (2). Άλλοι επίσης ερευνητές διαπίστωσαν ότι «Ο ρόλος του εντερικού μικροβιώματος στην επιρροή των πνευμονικών παθήσεων έχει διατυπωθεί καλά. Είναι επίσης γνωστό ότι η λοίμωξη του ιού του αναπνευστικού προκαλεί διαταραχές στο μικροβίωμα του εντέρου. Η διατροφή, οι περιβαλλοντικοί παράγοντες και η γενετική παίζουν σημαντικό ρόλο στη διαμόρφωση του μικροβιώματος του εντέρου που μπορούν να επηρεάσουν την ανοσία. Η ποικιλομορφία των μικροβίων του εντέρου μειώνεται στα γηρατειά και ο Covid-19 ήταν κυρίως θανατηφόρος σε ηλικιωμένους ασθενείς, γεγονός που υποδηλώνει και πάλι τον ρόλο που μπορεί να διαδραματίσει το μικροβίωμα του εντέρου σε αυτήν την ασθένεια. Η βελτίωση του προφίλ του μικροβιώματος του εντέρου μέσω εξατομικευμένης διατροφής και συμπληρωμάτων που είναι γνωστό ότι βελτιώνουν την ανοσία μπορεί να είναι ένας από τους προφυλακτικούς τρόπους με τους οποίους η επίδραση αυτής της ασθένειας μπορεί να ελαχιστοποιηθεί σε ηλικιωμένους και σε ανοσοκατασταλμένους ασθενείς» (3).
Παλαιότερα στοιχεία έδειξαν ότι το ιικό RNA του κορονοϊού SARS ήταν ανιχνεύσιμο στις αναπνευστικές εκκρίσεις και στα κόπρανα ορισμένων ασθενών μετά την έναρξη της ασθένειας για περισσότερο από ένα μήνα, αλλά ο ζωντανός ιός δεν μπορούσε να καλλιεργηθεί μετά την τρίτη εβδομάδα (4). Τώρα, πρόσφατη έκθεση προτείνει επίσης ότι το SARS-Cov2 RNA μπορεί να ανιχνευθεί στα κόπρανα ορισμένων ασθενών του Covid-19 (5). Αυτό μαζί με το γεγονός ότι ορισμένοι ασθενείς αυτής της νόσου έχουν διάρροια επισημαίνουν μια ξεχωριστή πιθανότητα εμπλοκής του άξονα του εντέρου-πνεύμονα και μπορεί να είναι το μικροβίωμα του εντέρου (6).
Εντερικό μικροβίωμα και ο άξονας εντέρου-πνεύμονα
Το ανθρώπινο μικροβίωμα του εντέρου αποτελείται από 1014 μόνιμους μικροοργανισμούς που περιλαμβάνουν βακτήρια, ιούς και μύκητες (7). Κατά κύριο λόγο, τα βακτήρια του εντέρου σε υγιή άτομα κυριαρχούνται από τέσσερα φύλα Actinobacteria, Firmicutes, Proteobacteria και Bacteroidetes (8). Το παχύ έντερο φιλοξενεί μια εξαιρετικά υψηλή πυκνότητα βακτηρίων στις οικογένειες Bacteroidaceae, Prevotellaceae, Rikenellaceae, Lachnospiraceae και Ruminococcaceae (9). Το μικροβίωμα του εντέρου παίζει βασικό ρόλο στην υγεία μέσω των προστατευτικών, τροφικών και μεταβολικών δράσεών του.
Ενώ τα μικρόβια λαμβάνουν κατοικία και τροφή από τον ξενιστή, αυτά τα μικρόβια με τη σειρά τους βοηθούν τον ξενιστή ρυθμίζοντας διάφορες φυσιολογικές λειτουργίες του ξενιστή, συμπεριλαμβανομένης της διατροφικής πέψης και προσφέροντας προστατευτική ανοσία έναντι των παθογόνων. Οι αλλοιώσεις του μικροβιώματος του εντέρου που μερικές φορές ονομάζονται συλλογικά ως «εντερική δυσβίωση» έχουν αποδειχθεί ότι σχετίζονται με διάφορες ασθένειες και διαταραχές όπως φλεγμονώδη νόσο του εντέρου (10), διαβήτη τύπου 2 (11), κατάθλιψη (12), καρδιαγγειακές παθήσεις (13).
Όπως και στο μικροβίωμα του εντέρου, υπάρχουν τώρα στοιχεία που υποδηλώνουν την παρουσία διακριτών μικροοργανισμών στον πνεύμονα (14). Στο έντερο κυριαρχούν τα Bacteroidetes και Firmicutes, ενώ τα Bacteroidetes, Firmicutes και Proteobacteria υπερισχύουν στον πνεύμονα (15). Είναι ενδιαφέρον ότι το εντερικό μικροβίωμα έχει αποδειχθεί ότι επηρεάζει την πνευμονική υγεία μέσω μιας ζωτικής διασταυρούμενης συνομιλίας μεταξύ του μικροβιώματος του εντέρου και των πνευμόνων που αναφέρεται ως «άξονας του εντέρου-πνεύμονα» (16). Ο άξονας του εντέρου-πνεύμονα υποτίθεται ότι είναι αμφίδρομος, που σημαίνει ότι οι ενδοτοξίνες, οι μικροβιακοί μεταβολίτες μπορούν να επηρεάσουν τον πνεύμονα μέσω του αίματος και όταν εμφανιστεί φλεγμονή στον πνεύμονα, μπορεί επίσης να επηρεάσει το μικροβίωμα του εντέρου (17).
Αυτό δημιουργεί μια ενδιαφέρουσα πιθανότητα ότι ο νέος SARS-Cov2 μπορεί επίσης να έχει αντίκτυπο στο μικροβίωμα του εντέρου. Στην πραγματικότητα, αρκετές μελέτες έχουν δείξει ότι οι αναπνευστικές λοιμώξεις σχετίζονται με μια αλλαγή στη σύνθεση του μικροβιώματος του εντέρου (18). Μία από τις σοβαρές κλινικές εκδηλώσεις του Covid-19 είναι η πνευμονία και η εξέλιξη σε σύνδρομο οξείας αναπνευστικής δυσχέρειας (ARDS) ειδικά σε ηλικιωμένους, ανοσοκατασταλμένους ασθενείς (19). Πολυάριθμες πειραματικές και κλινικές παρατηρήσεις έχουν δείξει ότι το μικροβίωμα του εντέρου παίζει βασικό ρόλο στην παθογένεση της σήψης και του ARDS (20). Η απώλεια της ποικιλίας των βακτηρίων του εντέρου μπορεί να οδηγήσει σε δυσβίωση που μπορεί στη συνέχεια να σχετίζεται με πολλές ασθένειες (21). Στην πραγματικότητα, οι ηλικιωμένοι έχουν μικρότερο ποικιλία μικροβιώματος στο έντερο και οι ευεργετικοί μικροοργανισμοί όπως το bifidobacterium χάνουν έδαφος (22). Δεδομένου ότι πολλοί ηλικιωμένοι και ανοσοκατασταλμένοι ασθενείς εξελίσσονται σε σοβαρά αρνητικά κλινικά αποτελέσματα, είναι επομένως δελεαστικό να υποθέσουμε ότι στο Covid-19, υπάρχει πιθανή διασταυρούμενη συζήτηση μεταξύ του πνεύμονα και του μικροβιώματος του εντέρου που μπορεί να επηρεάσει το αποτέλεσμα της κλινικής εκδήλωσης.
Τα μικρόβια του εντέρου και ο ρόλος στην ανοσία
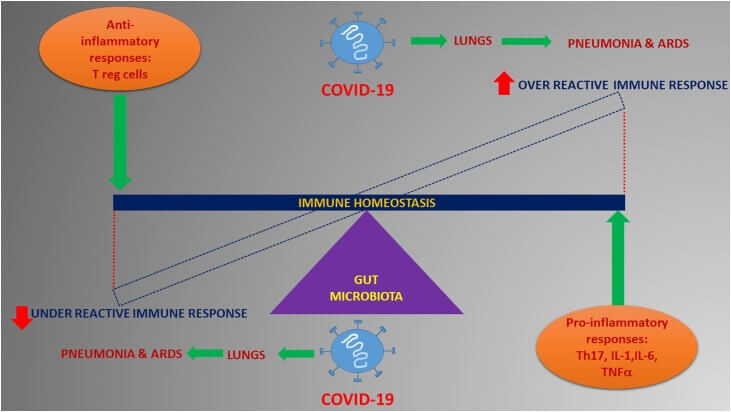
Οι αλληλεπιδράσεις του ξενιστή με τα μικροβιώματα είναι περίπλοκες, πολυάριθμες και αμφίδρομες. Τα μικρόβια του εντέρου υποτίθεται ότι ρυθμίζουν σημαντικά την ανάπτυξη και τη λειτουργία του έμφυτου και προσαρμοστικού ανοσοποιητικού συστήματος (23). Τα εντερικά βακτήρια εκκρίνουν αντιμικροβιακά πεπτίδια, ανταγωνίζονται για τα θρεπτικά συστατικά και τη θέση της κατοικίας βοηθώντας έτσι στην κατάσταση της ομοιόστασης (24). Τα μικρόβια του εντέρου και η ανοσολογική ομοιόσταση φαίνεται να έχουν σχέση εμπρός και πίσω και είναι επίσης ένα πεδίο μεγάλου ενδιαφέροντος και έντονης έρευνας στον τομέα των μολυσματικών ασθενειών. Επίσης, τα σήματα που προέρχονται από το σύνολο των μικροβίων του εντέρου είναι γνωστό ότι συντονίζουν τα ανοσοκύτταρα για προφλεγμονώδεις και αντιφλεγμονώδεις αποκρίσεις επηρεάζοντας έτσι την ευαισθησία σε διάφορες ασθένειες (25). Η ομοιόσταση του ανοσοποιητικού του εντέρου ενορχηστρώνεται από τη λεπτή ρύθμιση της ρυθμιστικής ισορροπίας των προ-φλεγμονωδών αποκρίσεων όπως το Th17 έναντι των φλεγμονωδών ρυθμιστικών Τ κυττάρων (Tregs) που ελέγχεται τελικά από τους κοινούς μικροοργανισμούς (26). Κατά την κατατρόπωση της απόκρισης σε παθογόνους λοιμώξεις όπως ο κοροναϊός, ένα υγιές μικροβίωμα του εντέρου ουσιαστικά θα μπορούσε να είναι καθοριστικής σημασίας για τη διατήρηση ενός άριστου ανοσοποιητικού συστήματος για την πρόληψη μιας σειράς υπερβολικών ανοσολογικών αντιδράσεων που τελικά καθίστανται επιβλαβείς για τους πνεύμονες και τα ζωτικά συστήματα οργάνων. Σε τέτοιες περιπτώσεις, καθίσταται επιτακτική ανάγκη να υπάρχει μια ισορροπημένη ανοσοαπόκριση όπου μια υπερβολικά αντιδραστική ή μια υποδραστική ανοσοαναπόκριση μπορεί να είναι εξίσου επακόλουθη για την επιδείνωση κλινικών επιπλοκών όπως η πνευμονία και το ARDS σε μια ιογενή νόσο όπως ο Covid-19 (Εικ. 1).
Οι μικροοργανισμοί χρησιμεύουν ως πηγή μοριακών προτύπων που σχετίζονται με μικροοργανισμούς (MAMP) καθώς και μοριακών προτύπων που σχετίζονται με παθογόνα (PAMPs). Τα δύο είναι αναγνωρίσιμα στα κύτταρα του ξενιστή μέσω υποδοχέων αναγνώρισης προτύπων (PRRs), οι οποίοι περιλαμβάνουν υποδοχείς που μοιάζουν με διόδια (TLR) και υποδοχείς σύνδεσης νουκλεοτιδίων (NODs) (27). Είναι σημαντικό ότι οι μεταβολίτες και τα ανοσορρυθμιστικά σήματα που εκκρίνουν τα μικρόβια του εντέρου που περιλαμβάνουν τα λιπαρά οξέα βραχείας αλυσίδας (SCFA) όπως τα βουτυρικά, οξικά και προπιονικά και δευτερογενή χολικά οξέα που εκκρίνονται από κοινά μικρόβια όπως βακτηριοειδή, γαλακτοβάκιλλοι και bifidobacteria συνδέονται με τους υποδοχείς τους σε έμφυτα κύτταρα όπως τα DC και τα μακροφάγα ρυθμίζοντας έτσι το μεταβολισμό και τις λειτουργίες τους (28-29). Στην πραγματικότητα, η εισαγωγή προβιοτικών στελεχών όπως το Bifidobacterium lactis σε υγιείς ηλικιωμένους εθελοντές είχε ως αποτέλεσμα μια σημαντική αύξηση της αναλογίας των μονοπύρηνων λευκοκυττάρων και την ογκοκτόνο δράση των φυσικών φονικών (ΝΚ) κυττάρων (30). Η σύνθεση του ισορροπημένου μικροβιώματος του εντέρου είναι γνωστό ότι επηρεάζει σημαντικά την αποτελεσματικότητα της πνευμονικής ανοσίας (31). Ποντίκια χωρίς μικρόβια (ποντίκια GF), χωρίς το εντερικό τους μικροβίωμα έχουν αποδειχθεί ότι έχουν εξασθενημένη ικανότητα κάθαρσης παθογόνων στον πνεύμονα (32). Η διαταραχή του μικροβιώματος του εντέρου με ευρεία χρήση αντιβιοτικών μπορεί επίσης να έχει παρόμοιο αποτέλεσμα όπως παρατηρήθηκε σε μελέτες πληθυσμού που δείχνουν ότι η αυξημένη χρήση πενικιλλίνης, κεφαλοσπορινών, μακρολίδων και κινολονών συσχετίστηκε με αυξημένο κίνδυνο καρκίνου του πνεύμονα στους ανθρώπους (33). Είναι ενδιαφέρον ότι η ιογενής λοίμωξη της γρίπης στην αναπνευστική οδό σε ποντίκια αυξάνει τα Enterobacteriaceae και μειώνει επίσης τους Lactobacilli και τους Lactococci στα εντερικά μικροβιώματα (34). Συνολικά, μπορεί να προταθεί ότι, δεδομένου ότι τα μικροβιώματα του εντέρου παίζουν τόσο σημαντικό ρόλο στην ανοσία, η λοίμωξη που προκαλείται από τον SARS-Cov2 πρέπει να μελετηθεί σωστά σε σχέση με το ρόλο που διαδραματίζουν οι εντερικοί και πνευμονικοί μικροοργανισμοί.
Διατροφή και μικρόβια του εντέρου
Η διατροφή παίζει σημαντικό ρόλο στη διαμόρφωση της σύνθεσης των μικροβίων της υγιούς χλωρίδας του εντέρου επηρεάζοντας έτσι την κατάσταση της υγείας του ξενιστή. Διαπιστώνονται διάφορες μορφές διατροφής που επηρεάζουν τα συγκεκριμένα πρότυπα σύνθεσης των μικροβίων της υγιούς χλωρίδας του εντέρου όπως, για παράδειγμα, έχει αναφερθεί η διαφορετική σύνθεση των μικροβίων με δίαιτες με βάση το λίπος και τις πρωτεΐνες σε σχέση με τις δίαιτες με βάση τα λαχανικά. Η μεσογειακή διατροφή επηρεάζει ευνοϊκά το μικροβίωμα του εντέρου (35). Είναι ενδιαφέρον να σημειωθεί ότι το μικροβίωμα του εντέρου των ζώων που τρέφονται με δίαιτα με υψηλή περιεκτικότητα σε λιπαρά και με υψηλή περιεκτικότητα σε σάκχαρα είναι πιο επιρρεπή σε διαταραχές του κιρκαδικού ρυθμού (36). Αντίθετα, το συστηματικό στρες, ο τραυματισμός των ιστών και η παρατεταμένη φλεγμονή μπορούν επίσης να προκαλέσουν οξείες αλλαγές στα μικρόβια της χλωρίδας του εντέρου, αποδεικνύοντας έτσι ότι περιβαλλοντικοί παράγοντες μαζί με τη διατροφή μπορούν να ρυθμίσουν τη σύνθεση του μικροβιώματος του εντέρου (37).
Έχει αποδειχθεί ότι διάφορα συστατικά των τροφίμων έχουν διαφορικά αποτελέσματα στα μικρόβια της χλωρίδας του εντέρου. Για παράδειγμα, η κατανάλωση πρωτεϊνικών εκχυλισμάτων ορού γάλακτος (whey) και μπιζελιού αυξάνει τα εντερικά βακτήρια του εντέρου bifidobacterium και lactobacillus, ενώ ο ορός γάλακτος φαίνεται επίσης ότι μειώνει τα παθογόνα βακτήρια Bacteroides fragilis και Clostridium perfringens (38). Σε αντίθεση με τους εύπεπτους υδατάνθρακες, οι μη εύπεπτοι υδατάνθρακες όπως οι ίνες και το ανθεκτικό άμυλο είναι γνωστό ότι υφίστανται ζύμωση από τους μικροοργανισμούς που κατοικούν στο έντερο (39). Οι διαιτητικές ίνες αποτελούν καλή πηγή υδατανθράκων προσβάσιμων στα μικρόβια της χλωρίδας του εντέρου που παρέχουν στον ξενιστή ενέργεια και βελτιώνουν την εντερική υγεία. Τα πρεβιοτικά έχουν μελετηθεί στο πλαίσιο της τροποποίησης της μικροβιακής χλωρίδας του ανθρώπινου εντέρου. Οι πρεβιοτικές ενώσεις όπως η ινουλίνη, η πολυδεξτρόζη και οι ίνες αραβοσίτου έχουν αποδειχθεί ότι βελτιώνουν την ανοσία, την ποικιλία του εντέρου, την πέψη κ.λπ. σε ανθρώπους και ειδικά σε ηλικιωμένους (40-41).
Εκτός από τις επιδράσεις στη σύνθεση των μικροβίων, τα πρεβιοτικά παράγουν επίσης αξιοσημείωτες μεταβολές στους ανοσοποιητικούς και μεταβολικούς δείκτες. Παράδειγμα, παρατηρήθηκε ότι η κατανάλωση μη εύπεπτων υδατανθράκων που υπάρχει σε δημητριακά ολικής αλέσεως οδήγησε σε μείωση της προφλεγμονώδους κυτοκίνης IL-6 και στην αντίσταση στην ινσουλίνη (42). Παρομοίως, παρατηρήθηκαν αυξημένα επίπεδα της αντιφλεγμονώδους κυτοκίνης στο πλάσμα IL10 με την πρόσληψη αμύλου αραβοσίτου με βουτυρυλιωμένη υψηλή αμυλόζη (43). Πρέπει να σημειωθεί ότι τα ευεργετικά αποτελέσματα των πρεβιοτικών πιστεύεται ότι προκαλούνται κυρίως από την παραγωγή βραχείας αλυσίδας λιπαρών οξέων (SCFA) και από την ενίσχυση του σχετιζόμενου με το γαστρεντερικό λεμφοειδούς ιστού (GALT) (44). Μια δίαιτα πλούσια σε φυτικές ίνες αλλάζει όχι μόνο τα μικρόβια της εντερικής χλωρίδας, αλλά μπορεί επίσης να επηρεάσει τα μικροβιώματα των πνευμόνων, υποδεικνύοντας την επίδραση της διατροφής στην ανοσία των πνευμόνων (45).
Όπως και τα πρεβιοτικά, ο ρόλος των προβιοτικών που γενικά ορίζονται ως «ζωντανοί μικροοργανισμοί, οι οποίοι, όταν χορηγούνται σε επαρκείς ποσότητες, παρέχουν οφέλη για την υγεία του ξενιστή» έχει αποδειχθεί ότι έχουν βαθιά επίδραση στην υγεία του ξενιστή. Στο έντερο τα προβιοτικά αναφέρονται κυρίως στα γένη Lactobacillus και Bifidobacterium και περιλαμβάνουν πολλά διαφορετικά στελέχη όπως L. johnsonii, L. fermentum, L. reuteri, L. paracasei, L. rhamnosus, L. acidophilus, L. plantarum, B. longum, B. breve, B. bifidum και B. animalis subsp. Lactis (46). Τροφές που έχουν υποστεί ζύμωση όπως καλλιεργημένα γαλακτοκομικά προϊόντα και γιαούρτι είναι εμπλουτισμένα με προβιοτικά. Γιαούρτι που περιέχει προβιοτικά έχει βρεθεί ότι μειώνει σημαντικά τον αριθμό των εντεροπαθογόνων E. coli και Helicobacter pylori (47). Οι γαλακτοβάκιλλοι και τα bifidobacteria έχουν χρησιμοποιηθεί επιτυχώς για την πρόληψη της διάρροιας του ταξιδιώτη (48). Τα προβιοτικά έχουν δείξει καλά αποτελέσματα στη βελτίωση των φλεγμονωδών καταστάσεων καθώς και στη ρύθμιση της έμφυτης ανοσίας χρησιμοποιώντας υποδοχείς τύπου διόδων και τις αντίστοιχες οδούς σηματοδότησης (49). Έρευνα με βάση μοντέλο ποντικών έδειξε ότι τα κύτταρα Treg, τα οποία ρυθμίζουν προς τα κάτω την αλλεργική απόκριση, μπορούν να προκληθούν από τη χορήγηση προβιοτικών βακτηρίων όπως το Lactobacillus rhamnosus, το Bifidobacterium lactis και το Bifidobacterium breve (50).
Είναι προφανές ότι η διατροφή που μεσολαβεί στη ρύθμιση των μικροβίων της χλωρίδας του εντέρου και σε κάποιο βαθμό ακόμη και τα μικρόβια της χλωρίδας των πνευμόνων μπορούν να επηρεάσουν την ανοσία. Επομένως, η δίαιτα ειδικά, εξατομικευμένη, μπορεί να βελτιώσει την προφύλαξη και μπορεί να χορηγηθεί προσεκτικά σε ασθενείς που πάσχουν από Covid-19 για να επιταχύνει την ανάρρωση και να βελτιώσει τα κλινικά αποτελέσματα (51).
Συμπεράσματα
Όσο πιο γρήγορα καταλαβαίνουμε τον Covid-19 τόσο καλύτερα θα είμαστε προετοιμασμένοι την επόμενη φορά. Η έρευνα στα μικρόβια της υγιούς εντερικής χλωρίδας έχει προωθήσει τις γνώσεις μας στον τομέα των χρόνιων και μολυσματικών ασθενειών. Η παρουσία του SARS Cov2 RNA στα κόπρανα ορισμένων ασθενών και η διάρροια σε λίγους υποδηλώνουν μια λεπτή σύνδεση μεταξύ του πνεύμονα και του εντέρου. Παρόλο που δεν αναφέρεται μετάδοση στοματικών κοπράνων, ωστόσο, μπορεί να υποτεθεί ότι πολλά ασυμπτωματικά παιδιά και ενήλικες μπορεί να ρίξουν σωματίδια μολυσματικού ιού στα κόπρανα οδηγώντας σε μόλυνση σε άλλους.
Η ποικιλομορφία των μικροβίων του εντέρου και η παρουσία ευεργετικών μικροοργανισμών στο έντερο μπορεί να διαδραματίσουν σημαντικό ρόλο στον προσδιορισμό της πορείας αυτής της ασθένειας. Ηλικιωμένοι, ασθενείς με ανοσοκαταστολή και ασθενείς με άλλες συν-νοσηρότητες όπως ο διαβήτης τύπου 2 και οι καρδιαγγειακές παθήσεις έχουν χαμηλή απόδοση στην καταπολέμηση του Covid-19. Είναι ενδιαφέρον να σημειωθεί ότι μια γενική ανισορροπία του μικροβίου του εντέρου που ονομάζεται «δυσβίωση» εμπλέκεται σε αυτούς τους ασθενείς και τους ηλικιωμένους. Είναι γνωστό ότι σε μοντέλα ποντικών, η απομάκρυνση ορισμένων βακτηρίων του εντέρου από αντιβιοτικό οδηγεί σε αυξημένη ευαισθησία σε λοίμωξη από τον ιό της γρίπης στους πνεύμονες (52). Επίσης, αρκετοί βακτηριακοί μεταβολίτες και βακτηριακά θραύσματα μπορούν να ρυθμίσουν την ανοσολογική απόκριση των πνευμόνων (53). Έτσι, είναι πολύ πιθανό ότι η δυσβίωση του εντέρου μπορεί να επηρεάζει και την κλινική εκδήλωση του Covid-19.
Η μικροβιακή δράση στις διαιτητικές ίνες είναι γνωστό ότι αυξάνει τα λιπαρά οξέα βραχείας αλυσίδας (SCFA) στο αίμα προστατεύοντας έτσι από την αλλεργική φλεγμονή στους πνεύμονες (53). Στην πραγματικότητα, τα πρεβιοτικά όπως το πίτουρο σίτου, οι φρουκτο-ολιγοσακχαρίτες (Fos) και οι γαλακτοσακχαρίτες (Gos) είναι γνωστό ότι αυξάνουν τα επίπεδα βουτυρικού άλατος μειώνοντας έτσι τη φλεγμονή και βελτιώνοντας τις συνθήκες στο άσθμα και την κυστική ίνωση (54). Ομοίως, πολλά προβιοτικά έχουν αποδειχθεί ότι βελτιώνουν ή ανακουφίζουν τις παθήσεις των πνευμονικών παθήσεων. Αυτά τα προβιοτικά προκαλούν αυτό το αποτέλεσμα τροποποιώντας το ανοσοποιητικό σύστημα. Μελέτες μοντέλων ποντικών έχουν δείξει ότι η εισαγωγή προβιοτικών βακτηρίων όπως ο Lactobacillus rhamnosus, το Bifidobacterium lactis και το Bifidobacterium breve μπορεί να ρυθμίσει την αλλεργική απόκριση (55). Ομοίως, η χορήγηση του Lactobacillus casei Shirota ή του Lactobacillus rhamnosus GG σε ασθενείς με κυστική ίνωση οδηγεί σε βελτίωση των παθήσεών τους (56).
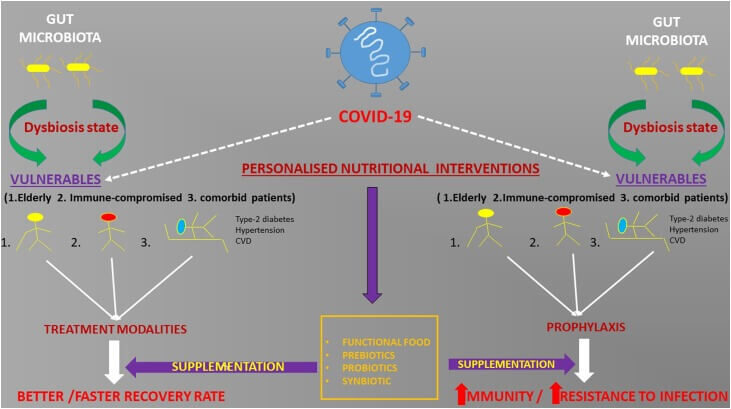
Δεδομένου ότι, η μικροβιακή χλωρίδα του εντέρου είναι εύπλαστη και διαμορφώνεται από τη διατροφή, είναι επιτακτική ανάγκη οι εξατομικευμένες στρατηγικές διατροφής να εφαρμοστούν ως συμπλήρωμα στις τρέχουσες θεραπείες ρουτίνας. Αυτό μπορεί να γίνει με τη δημιουργία προφίλ μικροβίων του εντέρου των μεμονωμένων ασθενών και με τη σύσταση αποτελεσματικής διατροφής, συμπεριλαμβανομένων εξειδικευμένων πρε/προβιοτικών, όπως FOS, GOS και διαφόρων στελεχών γαλακτοβακίλλων για τη βελτίωση της δυσβίωσης του εντέρου και, συνεπώς, της βελτίωσης της συνολικής ανοσοαπόκρισης σε αυτούς τους ασθενείς. Αυτό μπορεί να βελτιώσει και να επιταχύνει την ανάρρωση σε ασθενείς, ιδίως στους ηλικιωμένους και στους ανοσοκατασταλμένους που έχουν μολυνθεί από τον ιό SARS-Cov2 (Εικ. 2) (57). Μια άλλη γραμμή δράσης μπορεί να είναι η προφυλακτική παροχή εξειδικευμένων συμπληρωμάτων, συμπεριλαμβανομένων των πρεβιοτικών και των προβιοτικών για τους παρόχους υγείας που βρίσκονται στην πρώτη γραμμή για την αντιμετώπιση αυτής της ασθένειας. Έτσι, η αποτελεσματική διατροφική στρατηγική και συγκεκριμένες λειτουργικές τροφές που στοχεύουν στη μικροβιακή χλωρίδα για συγκεκριμένη ομάδα πληθυσμού μπορεί να είναι η ανάγκη της ώρας. Μπορεί να διεξαχθεί έρευνα για να εξεταστεί η επίδραση του Covid-19 στο προφίλ μικροβίων του εντέρου και αντιστρόφως. Δεύτερον, θα ήταν ενδιαφέρον να αναλύσουμε το ρόλο όχι μόνο των βακτηρίων αλλά και άλλων μικροοργανισμών όπως οι μύκητες που σχηματίζουν ένα πολύ εξειδικευμένο οικοσύστημα στο έντερο στον Covid-19. Τέλος, μπορεί επίσης να διερευνηθεί ο ρόλος των μικροβίων των πνευμόνων. Οι πληροφορίες από τέτοιες μελέτες θα προσθέσουν νέες διαστάσεις για την κατανόηση των μολυσματικών ασθενειών και μπορούν να βοηθήσουν στη λήψη αποφασιστικών ενεργειών στο μέλλον.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Yu L, Tong Y, Shen G, et al. Immunodepletion with Hypoxemia: A Potential High Risk Subtype of Coronavirus Disease 2019. MedRxiv, doi: https://doi.org/10.1101/2020.03.03.20030650 https://www.medrxiv.org/content/10.1101/2020.03.03.20030650v1
- Gou W, Fu Y, Yue L, et al. Gut microbiota may underlie the predisposition of healthy individuals to COVID-19. MedRxiv, doi: https://doi.org/10.1101/2020.04.22.20076091 https://www.medrxiv.org/content/10.1101/2020.04.22.20076091v1
- Dhar D, Mohanty A. Gut microbiota and Covid-19- possible link and implications. Virus Res. 2020;285:198018. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7217790/
- Chan KH, Poon LL, Cheng VC, Guan Y, Hung IF, Kong J, Yam LY, Seto WH, Yuen KY, Peiris JS. Detection of SARS coronavirus in patients with suspected SARS. Emerg Infect Dis. 2004 Feb;10(2):294-9. https://pubmed.ncbi.nlm.nih.gov/15030700/
- Wu Y, Guo C, Tang L, Hong Z, Zhou J, Dong X, Yin H, Xiao Q, Tang Y, Qu X, Kuang L, Fang X, Mishra N, Lu J, Shan H, Jiang G, Huang X. Prolonged presence of SARS-CoV-2 viral RNA in faecal samples. Lancet Gastroenterol Hepatol. 2020 May;5(5):434-435. https://pubmed.ncbi.nlm.nih.gov/32199469/
- Chan JF, Yuan S, Kok KH, To KK, Chu H, Yang J, Xing F, Liu J, Yip CC, Poon RW, Tsoi HW, Lo SK, Chan KH, Poon VK, Chan WM, Ip JD, Cai JP, Cheng VC, Chen H, Hui CK, Yuen KY. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020 Feb 15;395(10223):514-523. https://pubmed.ncbi.nlm.nih.gov/31986261/
- Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science. 2006 Jun 2;312(5778):1355-9. https://pubmed.ncbi.nlm.nih.gov/16741115/
- Villanueva-Millán MJ, Pérez-Matute P, Oteo JA. Gut microbiota: a key player in health and disease. A review focused on obesity. J Physiol Biochem. 2015 Sep;71(3):509-25. https://pubmed.ncbi.nlm.nih.gov/25749935/
- Hall AB, Tolonen AC, Xavier RJ. Human genetic variation and the gut microbiome in disease. Nat Rev Genet. 2017 Nov;18(11):690-699. https://pubmed.ncbi.nlm.nih.gov/28824167/
- Khan I, Ullah N, Zha L, Bai Y, Khan A, Zhao T, Che T, Zhang C. Alteration of Gut Microbiota in Inflammatory Bowel Disease (IBD): Cause or Consequence? IBD Treatment Targeting the Gut Microbiome. Pathogens. 2019 Aug 13;8(3):126. https://pubmed.ncbi.nlm.nih.gov/31412603/
- Gurung M, Li Z, You H, Rodrigues R, Jump DB, Morgun A, Shulzhenko N. Role of gut microbiota in type 2 diabetes pathophysiology. EBioMedicine. 2020 Jan;51:102590. https://pubmed.ncbi.nlm.nih.gov/31901868/
- Zalar B, Haslberger A, Peterlin B. The Role of Microbiota in Depression - a brief review. Psychiatr Danub. 2018 Jun;30(2):136-141. https://pubmed.ncbi.nlm.nih.gov/29930222/
- Tang WH, Kitai T, Hazen SL. Gut Microbiota in Cardiovascular Health and Disease. Circ Res. 2017 Mar 31;120(7):1183-1196. https://pubmed.ncbi.nlm.nih.gov/28360349/
- Bingula R, Filaire M, Radosevic-Robin N, Bey M, Berthon JY, Bernalier-Donadille A, Vasson MP, Filaire E. Desired Turbulence? Gut-Lung Axis, Immunity, and Lung Cancer. J Oncol. 2017;2017:5035371. https://pubmed.ncbi.nlm.nih.gov/29075294/
- Zhang D, Li S, Wang N, Tan HY, Zhang Z, Feng Y. The Cross-Talk Between Gut Microbiota and Lungs in Common Lung Diseases. Front Microbiol. 2020 Feb 25;11:301. https://pubmed.ncbi.nlm.nih.gov/32158441/
- Keely S, Talley NJ, Hansbro PM. Pulmonary-intestinal cross-talk in mucosal inflammatory disease. Mucosal Immunol. 2012 Jan;5(1):7-18. https://pubmed.ncbi.nlm.nih.gov/22089028/
- Dumas A, Bernard L, Poquet Y, Lugo-Villarino G, Neyrolles O. The role of the lung microbiota and the gut-lung axis in respiratory infectious diseases. Cell Microbiol. 2018 Dec;20(12):e12966. https://pubmed.ncbi.nlm.nih.gov/30329198/
- Groves HT, Higham SL, Moffatt MF, Cox MJ, Tregoning JS. Respiratory Viral Infection Alters the Gut Microbiota by Inducing Inappetence. mBio. 2020 Feb 18;11(1):e03236-19. https://pubmed.ncbi.nlm.nih.gov/32071269/
- Lake MA. What we know so far: COVID-19 current clinical knowledge and research. Clin Med (Lond). 2020 Mar;20(2):124-127. https://pubmed.ncbi.nlm.nih.gov/32139372/
- Dickson RP. The microbiome and critical illness. Lancet Respir Med. 2016 Jan;4(1):59-72. https://pubmed.ncbi.nlm.nih.gov/26700442/
- Mosca A, Leclerc M, Hugot JP. Gut Microbiota Diversity and Human Diseases: Should We Reintroduce Key Predators in Our Ecosystem? Front Microbiol. 2016 Mar 31;7:455. https://pubmed.ncbi.nlm.nih.gov/27065999/
- Nagpal R, Mainali R, Ahmadi S, Wang S, Singh R, Kavanagh K, Kitzman DW, Kushugulova A, Marotta F, Yadav H. Gut microbiome and aging: Physiological and mechanistic insights. Nutr Healthy Aging. 2018 Jun 15;4(4):267-285. https://pubmed.ncbi.nlm.nih.gov/29951588/
- Negi S, Das DK, Pahari S, Nadeem S, Agrewala JN. Potential Role of Gut Microbiota in Induction and Regulation of Innate Immune Memory. Front Immunol. 2019 Oct 25;10:2441. https://pubmed.ncbi.nlm.nih.gov/31749793/
- Moens E, Veldhoen M. Epithelial barrier biology: good fences make good neighbours. Immunology. 2012 Jan;135(1):1-8. https://pubmed.ncbi.nlm.nih.gov/22044254/
- Negi S, Pahari S, Bashir H, Agrewala JN. Gut Microbiota Regulates Mincle Mediated Activation of Lung Dendritic Cells to Protect Against Mycobacterium tuberculosis. Front Immunol. 2019 May 28;10:1142. https://pubmed.ncbi.nlm.nih.gov/31231363/
- Round JL, Mazmanian SK. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proc Natl Acad Sci U S A. 2010 Jul 6;107(27):12204-9. https://pubmed.ncbi.nlm.nih.gov/20566854/
- Ivanov II, Honda K. Intestinal commensal microbes as immune modulators. Cell Host Microbe. 2012 Oct 18;12(4):496-508. https://pubmed.ncbi.nlm.nih.gov/23084918/
- Rooks MG, Garrett WS. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 2016 May 27;16(6):341-52. https://pubmed.ncbi.nlm.nih.gov/27231050/
- Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nat Rev Gastroenterol Hepatol. 2018 Feb;15(2):111-128. https://pubmed.ncbi.nlm.nih.gov/29018272/
- Gill HS, Rutherfurd KJ, Cross ML, Gopal PK. Enhancement of immunity in the elderly by dietary supplementation with the probiotic Bifidobacterium lactis HN019. Am J Clin Nutr. 2001 Dec;74(6):833-9. https://pubmed.ncbi.nlm.nih.gov/11722966/
- Bingula R, Filaire M, Radosevic-Robin N, Bey M, Berthon JY, Bernalier-Donadille A, Vasson MP, Filaire E. Desired Turbulence? Gut-Lung Axis, Immunity, and Lung Cancer. J Oncol. 2017;2017:5035371. https://pubmed.ncbi.nlm.nih.gov/29075294/
- Fagundes CT, Amaral FA, Vieira AT, Soares AC, Pinho V, Nicoli JR, Vieira LQ, Teixeira MM, Souza DG. Transient TLR activation restores inflammatory response and ability to control pulmonary bacterial infection in germfree mice. J Immunol. 2012 Feb 1;188(3):1411-20. https://pubmed.ncbi.nlm.nih.gov/22210917/
- Boursi B, Mamtani R, Haynes K, Yang YX. Recurrent antibiotic exposure may promote cancer formation-Another step in understanding the role of the human microbiota? Eur J Cancer. 2015 Nov;51(17):2655-64. https://pubmed.ncbi.nlm.nih.gov/26338196/
- Looft T, Allen HK. Collateral effects of antibiotics on mammalian gut microbiomes. Gut Microbes. 2012 Sep-Oct;3(5):463-7. https://pubmed.ncbi.nlm.nih.gov/22825498/
- De Filippis F, Pellegrini N, Vannini L, Jeffery IB, La Storia A, Laghi L, Serrazanetti DI, Di Cagno R, Ferrocino I, Lazzi C, Turroni S, Cocolin L, Brigidi P, Neviani E, Gobbetti M, O'Toole PW, Ercolini D. High-level adherence to a Mediterranean diet beneficially impacts the gut microbiota and associated metabolome. Gut. 2016 Nov;65(11):1812-1821. https://pubmed.ncbi.nlm.nih.gov/26416813/
- Voigt RM, Forsyth CB, Green SJ, Mutlu E, Engen P, Vitaterna MH, Turek FW, Keshavarzian A. Circadian disorganization alters intestinal microbiota. PLoS One. 2014 May 21;9(5):e97500. https://pubmed.ncbi.nlm.nih.gov/24848969/
- Earley ZM, Akhtar S, Green SJ, Naqib A, Khan O, Cannon AR, Hammer AM, Morris NL, Li X, Eberhardt JM, Gamelli RL, Kennedy RH, Choudhry MA. Burn Injury Alters the Intestinal Microbiome and Increases Gut Permeability and Bacterial Translocation. PLoS One. 2015 Jul 8;10(7):e0129996. https://pubmed.ncbi.nlm.nih.gov/26154283/
- Swiątecka D, Narbad A, Ridgway KP, Kostyra H. The study on the impact of glycated pea proteins on human intestinal bacteria. Int J Food Microbiol. 2011 Jan 31;145(1):267-72. https://pubmed.ncbi.nlm.nih.gov/21276631/
- De Filippis F, Pellegrini N, Vannini L, Jeffery IB, La Storia A, Laghi L, Serrazanetti DI, Di Cagno R, Ferrocino I, Lazzi C, Turroni S, Cocolin L, Brigidi P, Neviani E, Gobbetti M, O'Toole PW, Ercolini D. High-level adherence to a Mediterranean diet beneficially impacts the gut microbiota and associated metabolome. Gut. 2016 Nov;65(11):1812-1821. https://pubmed.ncbi.nlm.nih.gov/26416813/
- Kleessen B, Sykura B, Zunft HJ, Blaut M. Effects of inulin and lactose on fecal microflora, microbial activity, and bowel habit in elderly constipated persons. Am J Clin Nutr. 1997 May;65(5):1397-402. https://pubmed.ncbi.nlm.nih.gov/9129468/
- Bouhnik Y, Achour L, Paineau D, Riottot M, Attar A, Bornet F. Four-week short chain fructo-oligosaccharides ingestion leads to increasing fecal bifidobacteria and cholesterol excretion in healthy elderly volunteers. Nutr J. 2007 Dec 5;6:42. https://pubmed.ncbi.nlm.nih.gov/18053236/
- Keim NL, Martin RJ. Dietary whole grain-microbiota interactions: insights into mechanisms for human health. Adv Nutr. 2014 Sep;5(5):556-7. https://pubmed.ncbi.nlm.nih.gov/25469393/
- West NP, Christophersen CT, Pyne DB, Cripps AW, Conlon MA, Topping DL, Kang S, McSweeney CS, Fricker PA, Aguirre D, Clarke JM. Butyrylated starch increases colonic butyrate concentration but has limited effects on immunity in healthy physically active individuals. Exerc Immunol Rev. 2013;19:102-19. https://pubmed.ncbi.nlm.nih.gov/23977723/
- Schley PD, Field CJ. The immune-enhancing effects of dietary fibres and prebiotics. Br J Nutr. 2002 May;87 Suppl 2:S221-30. https://pubmed.ncbi.nlm.nih.gov/12088522/
- Trompette A, Gollwitzer ES, Yadava K, Sichelstiel AK, Sprenger N, Ngom-Bru C, Blanchard C, Junt T, Nicod LP, Harris NL, Marsland BJ. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis. Nat Med. 2014 Feb;20(2):159-66. https://pubmed.ncbi.nlm.nih.gov/24390308/
- Bingula R, Filaire M, Radosevic-Robin N, Bey M, Berthon JY, Bernalier-Donadille A, Vasson MP, Filaire E. Desired Turbulence? Gut-Lung Axis, Immunity, and Lung Cancer. J Oncol. 2017;2017:5035371. https://pubmed.ncbi.nlm.nih.gov/29075294/
- Yang YJ, Sheu BS. Probiotics-containing yogurts suppress Helicobacter pylori load and modify immune response and intestinal microbiota in the Helicobacter pylori-infected children. Helicobacter. 2012 Aug;17(4):297-304. https://pubmed.ncbi.nlm.nih.gov/22759330/
- McFarland LV. Meta-analysis of probiotics for the prevention of traveler's diarrhea. Travel Med Infect Dis. 2007 Mar;5(2):97-105. https://pubmed.ncbi.nlm.nih.gov/17298915/
- West CE, Dzidic M, Prescott SL, Jenmalm MC. Bugging allergy; role of pre-, pro- and synbiotics in allergy prevention. Allergol Int. 2017 Oct;66(4):529-538. https://pubmed.ncbi.nlm.nih.gov/28865967/
- Feleszko W, Jaworska J, Rha RD, Steinhausen S, Avagyan A, Jaudszus A, Ahrens B, Groneberg DA, Wahn U, Hamelmann E. Probiotic-induced suppression of allergic sensitization and airway inflammation is associated with an increase of T regulatory-dependent mechanisms in a murine model of asthma. Clin Exp Allergy. 2007 Apr;37(4):498-505. https://pubmed.ncbi.nlm.nih.gov/17430345/
- Dhar D, Mohanty A. Gut microbiota and Covid-19- possible link and implications. Virus Res. 2020;285:198018. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7217790/
- Looft T, Allen HK. Collateral effects of antibiotics on mammalian gut microbiomes. Gut Microbes. 2012 Sep-Oct;3(5):463-7. https://pubmed.ncbi.nlm.nih.gov/22825498/
- Trompette A, Gollwitzer ES, Yadava K, Sichelstiel AK, Sprenger N, Ngom-Bru C, Blanchard C, Junt T, Nicod LP, Harris NL, Marsland BJ. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis. Nat Med. 2014 Feb;20(2):159-66. https://pubmed.ncbi.nlm.nih.gov/24390308/
- Anand S, Mande SS. Diet, Microbiota and Gut-Lung Connection. Front Microbiol. 2018 Sep 19;9:2147. https://pubmed.ncbi.nlm.nih.gov/30283410/
- Feleszko W, Jaworska J, Rha RD, Steinhausen S, Avagyan A, Jaudszus A, Ahrens B, Groneberg DA, Wahn U, Hamelmann E. Probiotic-induced suppression of allergic sensitization and airway inflammation is associated with an increase of T regulatory-dependent mechanisms in a murine model of asthma. Clin Exp Allergy. 2007 Apr;37(4):498-505. https://pubmed.ncbi.nlm.nih.gov/17430345/
- West CE, Dzidic M, Prescott SL, Jenmalm MC. Bugging allergy; role of pre-, pro- and synbiotics in allergy prevention. Allergol Int. 2017 Oct;66(4):529-538. https://pubmed.ncbi.nlm.nih.gov/28865967/
- Dhar D, Mohanty A. Gut microbiota and Covid-19- possible link and implications. Virus Res. 2020;285:198018. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7217790/



Σχόλια Αναγνωστών